2023年4月3日,廈門大學附屬第一醫(yī)院葉峰課題組與廈門大學劉文課題組聯合在在中科院1區(qū)TOP期刊The EMBO Journal(IF:14.05)雜志上發(fā)表題為“CircPVT1 promotes ER-positive breast tumorigenesis and drug resistance by targeting ESR1 and MAVS”的研究成果,。該研究發(fā)現,,環(huán)狀RNA circPVT1在乳腺癌中高表達,通過靶向ESR1 mRNA和MAVS蛋白雙重作用機制促進乳腺癌發(fā)生發(fā)展,。

乳腺癌是全球女性發(fā)病率和死亡率最高的癌癥,,嚴重威脅女性的健康。雌激素受體(Estrogen receptor, ER)陽性乳腺癌約占全部乳腺癌的70%,,雌激素(Estrogen, E2)水平紊亂誘導的ER靶基因的異常激活是該亞型乳腺癌發(fā)生發(fā)展的重要驅動因素之一,。靶向 ER 及上游通路的治療被稱作內分泌治療,是 ER 陽性乳腺癌最主要的治療手段,。?然而,,ER 陽性乳腺癌患者中存在一部分原發(fā)耐藥,或者經過長程或多線的內分泌治療之后出現獲得性耐藥的難題,。?環(huán)狀 RNA(circular RNA,,circRNA) 被報道在生物體的生長發(fā)育和疾病的發(fā)生發(fā)展等過程中發(fā)揮了重要的功能,其中circPVT1被報道在多種癌癥中異常表達,,并參與了癌癥的發(fā)生發(fā)展,。然而,circPVT1在ER陽性乳腺癌發(fā)生發(fā)展及耐藥復發(fā)中的功能和作用機制尚不明確,。
該研究首先篩選,、鑒定了乳腺癌細胞系MCF7細胞中高表達的環(huán)狀RNA。通過功能實驗確定了對乳腺癌細胞生長起關鍵作用的環(huán)狀RNA,,其中circPVT1顯著促進了乳腺癌細胞的生長和成瘤能力,。進一步通過乳腺癌臨床樣本檢測到circPVT1在癌癥樣本中高表達。CircPVT1由非編碼RNA PVT1的2號外顯子成環(huán)形成,并且高度富集在細胞質中,。聚焦于ER陽性乳腺癌,,RNA-seq測序分析表明circPVT1正調控了ERα靶基因的表達。進一步通過競爭性內源性RNA(competing endogenous RNA, ceRNA)網絡分析表明circPVT1通過競爭結合miR-181a-2-3p穩(wěn)定ESR1 mRNA,,從而促進ERα蛋白表達,,進而促進ERα下游靶基因的表達。ERα靶基因激活與細胞周期,、細胞生長,、代謝和耐藥等密切相關。另一方面,,circPVT1負調控了I型干擾素相關基因的表達。機制探究表明,,circPVT1通過與MAVS相互作用破壞RIGI-MAVS復合物的形成,,抑制MAVS下游I型干擾素信號通路激活,促進了腫瘤細胞的免疫逃逸,。綜上,,circPVT1通過競爭性內源性RNA和蛋白腳手架雙重作用機制促進乳腺癌的發(fā)生發(fā)展。研究人員進而設計了靶向circPVT1的反義寡核苷酸藥物(Anti-sense oligonucleotides,,ASO),,證明其有效抑制了乳腺癌細胞和腫瘤的生長。
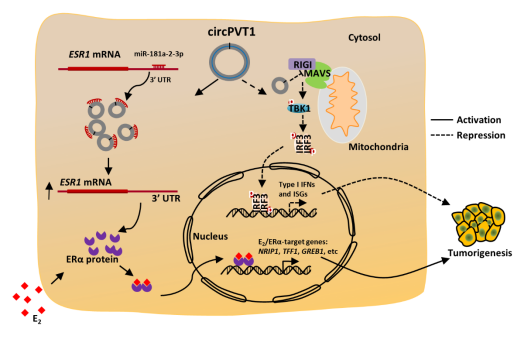
模式圖:CircPVT1競爭性結合miR-181a-2-3p促進ESR1表達以及結合MAVS抑制I型干擾素通路激活,,促進ER陽性乳腺癌發(fā)生發(fā)展的雙重作用機制,。
本研究揭示了乳腺癌中高表達的環(huán)狀RNA circPVT1通過競爭性內源性RNA和蛋白腳手架促進癌癥發(fā)生的雙重作用機理,證明靶向circPVT1能有效抑制乳腺癌的生長,。為乳腺癌的治療提供了潛在的藥物靶點和聯合治療策略,。
葉峰教授和劉文教授為本文的共同通訊作者,由廈門大學附屬第一醫(yī)院和廈門大學聯合培養(yǎng)博士后易佳和劉文課題組博士研究生王雷為本文的共同第一作者,。